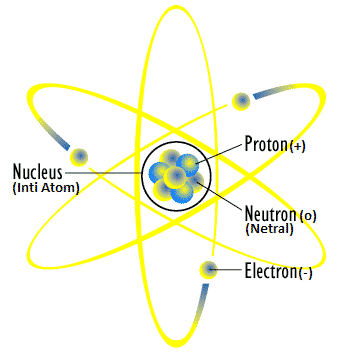
Atom adalah bagian terkecil dari suatu unsur yang masih memiliki sifat unsur tersebut. Struktur atom menggambarkan bagaimana partikel-partikel dalam atom tersusun. Atom tersusun atas inti atom dan dikelilingi elektron-elektron yang tersebar dalam kulit-kulitnya.
Elektron
Proton
Inti Atom
Neutron
Daftar Pustaka :
https://www.gurupendidikan.co.id/pengertian-partikel-penyusun-atom-menurut-para-ahli/https://www.google.com/url?sa=t&source=web&rct=j&url=https://id.m.wikipedia.org/wiki/Atom&ved=2ahUKEwiNnMautMHkAhUJSX0KHS_jDbMQFjAHegQIBBAB&usg=AOvVaw1Hjc6k4nCOdzJG7Pc5L62O
BILANGAN KUANTUM
Bilangan kuantum (bahasa Inggris: Quantum number) adalah bilangan yang menyatakan kedudukan atau posisi elektron dalam atomyang diwakili oleh suatu nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum menggambarkan sifat elektron dalam orbital.
Bilangan kuantum menentukan tingkat energiutama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron. Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum.
Bilangan kuantum merupakan salah satu ciri khas dari model atom mekanika kuantumatau model atom modern yang dicetuskan oleh Erwin Schrödinger. Dalam mekanika kuantum, bilangan kuantum diperlukan untuk menggambarkan distribusi elektron dalam atom hidrogen dan atom-atom lain. Bilangan-bilangan ini diturunkan dari penyelesaian matematis persamaan Schrödinger untuk atom hidrogen.
Jenis bilangan kuantum adalah:

Bilangan ini menentukan tingkat energi utama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron. Setiap sistem kuantum dapat memiliki satu atau lebih bilangan kuantum.
- Bilangan kuantum utama (n) yang menyatakan tingkat energi.
- Bilangan kuantum azimut/momentum sudut (ℓ) yang menyatakan bentuk orbital.
- Bilangan kuantum magnetik (m) yang menyatakan orientasi orbital dalam ruang tiga dimensi.
- Bilangan kuantum spin (s) yang menyatakan spin elektron pada sebuah atom.
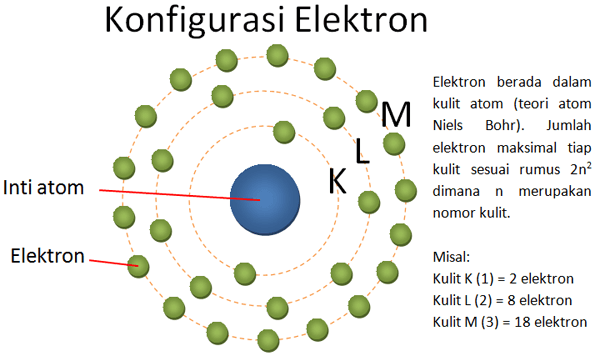
Bilangan kuantum utama (primer) digunakan untuk menyatakan tingkat energi utama yang dimiliki oleh elektron dalam sebuah atom. Bilangan kuantum utama tidak pernah bernilai nol. Bilangan kuantum utama dapat mempunyai nilai semua bilangan positif, yaitu 1,2,3,4 dan seterusnya. Sedangkan kelopak atom dinyatakan dengan huruf K,L,M,N dan seterusnya[3].
contoh:
n=1 elektron berada pada kelopak K;
n=2 elektron berada pada kelopak L;
n=3 elektron berada pada kelopak M;
n=4 elektron berada pada kelopak N; dan seterusnya
Bilangan kuantum utama juga berhubungan dengan jarak rata-rata elektron dari inti dalam orbital tertentu. Semakin besar n, semakin besar jarak rata-rata elektron dalam orbital tersebut dari inti dan oleh karena itu semakin besar orbitalnya
Bilangan kuantum azimuth (l)
Bilangan kuantum azimuth (l) membagi kulit menjadi orbital- orbital yang lebih kecil (subkulit). Untuk setiap kulit n, memiliki bilangan kuantum azimuth (l) mulai l = 0 sampai l = (n – 1). Biasanya subkulit dengan l = 1, 2, 3, ..., (n – 1) diberi simbol s, p, d, f, dan seterusnya. Bilangan kuantum azimuth (l) menggambarkan bentuk orbital. Selain itu, pada atom yang memiliki dua elektron atau lebih bilangan kuantum azimuth(l) juga menyatakan tingkat energi. Untuk kulit yang sama, energi subkulit akan meningkat dengan bertambahnya nilai l. Jadi, subkulit s memiliki tingkat energi yang terendah, diikuti subkulit p, d, f, dan seterusnya.

Subkulit pada bilangan kuantum azimuth(l).
c. Bilangan kuantum magnetik (m)
Bilangan kuantum magnetik (m) membagi bilangan kuantum azimut menjadi orbital-orbital. Jumlah bilangan kuantum magnetik (m) untuk setiap bilangan kuantum azimut (l) dimulai dari m = – l sampai m = + l .
Hubungan bilangan kuantum utama (n), bilangan kuantum azimuth (l), dan bilangan kuantum magnetik (m).
Apa yang dapat kalian simpulkan dari Tabel diatas? Dari Tabel diatas terlihat subkulit s mempunyai 1 orbital, subkulit p mempunyai 3 orbital, subkulit d mempunyai 5 orbital, dan subkulit f mempunyai 7 orbital.
d. Bilangan kuantum spin (s)
Bilangan kuantum spin (s) menunjukkan arah putaran atau spin atau rotasi sebuah elektron pada sumbunya. Arah rotasi elektron bisa searah jarum jam (clockwise) atau berlawanan arah dengan jarum jam (anticlockwise). Oleh karena itu diberi nilai ± 1/2. Arah rotasi yang searah jarum jam diberi notasi + 1/2 atau simbol ↑ . Sedangkan yang berlawanan arah dengan jarum jam diberi notasi – 1/2 atau ↓ . Bilangan kuantum spin merupakan dasar pengisian elektron dalam orbital .

Elektron mengelilingi sumbunya menimbulkan medan magnet.
Elektron-elektron yang ada dalam atom tidak mungkin berada dalam keadaan yang sama persis antara satu atom dengan atom lain. Keberadaan elektron dalam atom bersifat khas. Prinsip ini dikemukakan oleh Wolfgang Pauli, 1925 (dikenal Pauli). Pauli mengusulkan postulat bahwa sebuah elektron dapat berada dalam dua kemungkinan keadaan yang ditandai dengan bilangan kuantum spin + 1/2 atau – 1/2, atau dengan kata lain setiap orbital hanya dapat ditempati oleh maksimal dua elektron dengan spin yang berbeda.
DAFTAR PUSTAKA :
http://www.ilmukimia.org/2013/05/bilangan-kuantum.html
http://www.ilmukimia.org/2013/05/bilangan-kuantum.html
Konfigurasi Elektron
Apa itu pengertian konfigurasi elektron ?
Konfigurasi elektron adalah sebuah penggambaran mengenai posisi elektron di dalam suatu atom. Namun sebelum memahami lebih lanjut mengenai konfigurasi elektron, terlebih dahulu kita pahami teori atom dan mekanika kuantum. Serta apa itu orbital?.
A. Azas Aufbau
Azas Aufbau menyatakan bahwa :“Pengisian elektron dimulai dari subkulit yang berenergi paling rendah dilanjutkan pada subkulit yang lebih tinggi energinya”. Dalam setiap sub kulit mempunyai batasan elektron yang dapat diisikan yakni :
Subkulit s maksimal berisi 2 elektron
Subkulit p maksimal berisi 6 elektron
Subkulit d maksimal berisi 10 elektron
Subkulit f maksimal berisi 14 elektron
Berdasarkan ketentuan tersebut maka urutan pengisian (kofigurasi) elektron mengikuti tanda panah pada gambar berikut!
Berdasarkan diagram di atas dapat disusun urutan konfigurasi elektron sebagai berikut :
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 …. dan seterusnya
Keterangan :
Penulisan konfigurasi elektron dapat disingkat dengan penulisan atom dari golongan gas mulia yaitu : He (2 elektron), Ne (10 elektron), Ar (18 elektron), Kr (36 elektron), Xe (54 elektron) dan Rn ( 86 elektron). Hal ini karena pada konfigurasi elektron gas mulia setiap sub kulitnya terisi elektron secara penuh.
Konfigurasi elektron dalam atom selain diungkapkan dengan diagram curah hujan, seringkali diungkapkan dalam diagram orbital. Ungkapan yang kedua akan bermanfaat dalam menentukan bentuk molekul dan teori hibridisasi.
Yang harus diperhatikan dalam pembuatan diagram orbital :
1. Orbital-orbital dilambangkan dengan kotak
2. Elektron dilambangkan sebagai tanda panah dalam kotak
3. Banyaknya kotak ditentukan berdasarkan bilangan kuantum magnetik, yaitu:
4. Untuk orbital-orbital yang berenergi sama dilambangkan dengan sekelompok kotak yang bersisian, sedangkan orbital dengan tingkat energi berbeda digambarkan dengan kotak yang terpisah.
5. Satu kotak orbital berisi 2 elektron, satu tanda panah mengarah ke atas dan satu lagi mengarah ke bawah. Pengisan elektron dalam kotak-kotak orbital menggunakan aturan Hund.
B. Aturan Hund
Frederick Hund, 1927 (dikenal Hund) mengatakan bahwa pengisian elektron pada orbital yang setingkat (energinya sama) dalam satu orbital adalah satu per satu dengan arah spin yang sama sebelum berpasangan. Asas ini dikemukakan berdasarkan penalaran bahwa energi tolak-menolak antara dua elektron akan minimum jika jarak antara elektron berjauhan. Untuk lebih memahaminya, perhatikan gambaran pengisian elektron pada orbital p.
Contoh pengisian yang benar:
Contoh pengisian yang salah
C. Larangan Pauli
Pauli mengemukakan hipotesisnya yang menyatakan bahwa dalam satu atom tidak mungkin dua elektron mempunyai keempat bilangan kuantum sama. Misal, 2 elektron akan menempati subkulit 1s. Tiga bilangan kuantum pertama akan mempunyai nilai yang sama (n = 1, l = 0, m = 0). Untuk itu bilangan kuantum yang terakhir, yaitu bilangan kuantum spin(s) harus mempunyai nilai berbeda ( + 1/2 atau -1/2 ).
Dengan kata lain, setiap orbital maksimal hanya dapat terisi 2 elektron dengan arah spin berlawanan. Sebagai contoh, pengisian elektron pada orbital 1s digambarkan sebagai berikut.

Mengapa pada satu orbital hanya dapat ditempati maksimal oleh dua elektron? Karena jika ada elektron ketiga, maka elektron tersebut pasti akan mempunyai spin yang sama dengan salah satu elektron yang terdahulu dan itu akan melanggar asas larangan Pauli dengan demikian tidak dibenarkan. Jumlah elektron maksimal untuk tiap subkulit sama dengan dua kali dari jumlah orbitalnya.
- orbital s maksimal 2 elektron
- orbital p maksimal 6 elektron
- orbital d maksimal 10 elektron, dan
- orbital f maksimal 14 elektron.
Terimakasih Telah Berkunjung, Semoga Bermanfaat 😊
DAFTAR PUSTAKA :
















Good 👍
BalasHapus👍👍👍
BalasHapusMantep
BalasHapusBagus banget ih
BalasHapusBagus banget
BalasHapusSaya suka
Nice
BalasHapusPenjelasan nya bagus,gambar"nya lengkap sesuai penjelasan
BalasHapusWah beneran ngebantu banget sih ini:)
BalasHapusNice
BalasHapusMantap, sangat membantu
BalasHapusTerimakasih atas penjelasan nya��
BalasHapusNicee
BalasHapusGood
BalasHapusGood
BalasHapusGood
BalasHapusgood job
BalasHapusGood
BalasHapus